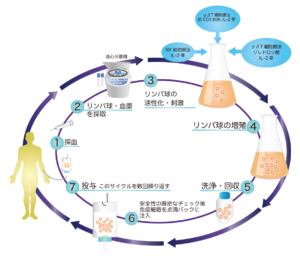
活性化自己リンパ球療法
患者さんから採取した血液からリンパ球やNK細胞を分離し、活性化・増殖させ、体内に戻すことでがん細胞を攻撃させる治療法です。
主に、αβ(アルファベータ)型のTリンパ球を活性化させることを基本としています。
がんに対抗する免疫細胞にもいくつか種類があり、患者さんの症状やがんの性質によって活性化させる細胞を使い分ける場合もあります。
NK細胞や、γδ(ガンマデルタ)T細胞などを主に活性化させる場合、NK細胞療法、γδT細胞療法という呼び名で呼ばれます。
<活性化自己リンパ球療法の種類>
αβT細胞療法(CD3-LAK療法)
患者さんから試験管3本程度の血液をお預かりしその中からTリンパ球を分離し、体外で2週間程度培養、強力に活性化させ数十億個以上に増やし患者さんの体内に戻すことでがんの成長を抑制していく治療です。
活性化自己NK細胞療法
患者さんの血液中からNK細胞のみを活性化・増殖させたものを体内に戻す治療法で、NK細胞自体は抗原特異性が無く直接目的箇所へ向かうことができ他の免疫細胞と比べても柔軟にがん細胞を攻撃することができます。
NK細胞の特徴
αβ(アルファベータ)型のTリンパ球を活性化させることを基本とする活性化自己リンパ球療法に加え、選択的にNK細胞を増殖させる技術が利用できるようになりました。
これまでは、NK細胞を増殖させても染色体に異常が生じ、安心して利用できる技術は確立できていませんでした。当社が採用した新たなNK細胞の培養法は、このような問題点を解消した安心できる技術です。
αβ型Tリンパ球はHLAクラスI が発現しているがん細胞を標的とするのに対し、NK細胞はHLAクラスI の発現が低下・消失したがん細胞を標的に傷害性を示します。
細胞は強度なストレスにさらされると、その細胞表面上にMICA等のストレス誘導性のタンパク(群)を提示するようになります。がん細胞表面にはこのMICA等のストレス誘導性のタンパク質が大量に発現してきます。
NK細胞はMICAを認識できるNKG2Dとよばれる細胞表面の活性化受容体をもっており、これらが結合することでがん細胞を殺傷する機構を兼ね備えています。
患者さん個々のがんの中にはHLAクラスI 陽性・陰性の両タイプのがん細胞が混在している場合もあり、これら二種類の活性化細胞を患者さんに合わせて選択できるようになったことは、治療効果増強につながるものと考えられます。
また、NK細胞は抗体医薬でがん細胞が傷害される機構である、ADCC(抗体依存性細胞傷害)を担う中心の細胞であり、製薬企業が開発を進める抗体医薬との相乗効果が期待されています。
培養法の概略
活性化自己リンパ球療法と同様に、患者さんの末梢血から単核球を分取して培養に使用します。
αβ型 Tリンパ球を増殖させる場合には、抗CD3抗体を固相化したフラスコで培養を開始します。
一方、NK細胞を増殖させる場合には、NK細胞を刺激する抗体を利用します。
また、それぞれの細胞に適した培地を使い分けることで、αβ型 Tリンパ球またはNK細胞だけを選択的に増殖させます。
樹状細胞ワクチン療法(細胞性免疫誘導型)
免疫を担当する細胞の中で「抗原提示」と呼ばれる樹状細胞は、がんの目印(抗原)を他の細胞に伝える司令塔の役割を果たす重要な細胞です。樹状細胞ワクチン療法(DCワクチン療法)は、この樹状細胞を活用しがん細胞のみ攻撃する免疫細胞(CTL)を増幅させ、より効率的にがん細胞を攻撃することを目的とする治療法をいいます。
樹状細胞(DendriticCell=DC)とは、体内でがん細胞を直接攻撃するTリンパ球に、がんの目印(がん抗原)を教え、攻撃の指示を与える免疫細胞です。
がん細胞のタンパク質が樹状細胞に取り込まれると、それが細胞内で分解され、患者さんのがんの情報(抗原)として樹状細胞に記憶されます。すると樹状細胞は記憶した抗原を表面に目印として出します。それを患者さんの体内に戻すことで、「目印」を頼りにがん細胞だけを集中的に攻撃するTリンパ球(細胞傷害性Tリンパ球:CTL)を効率よく誘導することができるのです。
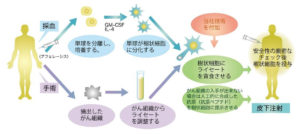
自己がん抗原刺激型CTL療法
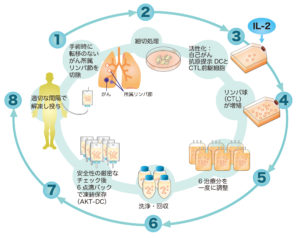
AKT-DC(Activated Killer T cells and dendritic cells)
手術後の再発予防にエビデンスのある理想的な治療法
AKT-DC療法は、2012年まで千葉県がんセンター木村秀樹先生のもとで国の認めた先進医療として臨床研究され、がん治療として提供されてきました。
肺がんの根治手術を施された患者さんに対し、手術時に切除した所属リンパ節を用いて自己のリンパ球を増殖・活性化させ、強力にCTL (細胞傷害性Tリンパ球)を誘導する治療法です。
がん所属リンパ節には患者さん自身の複数のがん抗原を提示しているDC(樹状細胞)が自然に存在しており、抗CD3抗体の刺激なしにこれらの抗原提示によって増殖してくるキラーT細胞を中心に治療に用い、これにより増殖したリンパ球の多くがCTLとして活性化されます。術後の再発予防として理想的なテーラーメイド型の個別化免疫細胞療法と言えるでしょう。
免疫細胞療法の有効性
がん再発予防における免疫細胞療法の効果と実際
Cancer Immunology Immunotherapy 誌、2014年、DOI 10.1007/s00262-014-1613-0 千葉県済生会習志野病院木村秀樹先生等による論文より
2007年4月から2012年7月に行った初発肺がん手術556例中、適格(ステージ1B~IV、非小細胞がん、76歳未満、PS 0または1 等)を満たす103例を対象とし、統計は、最終的に無作為で分別したグループA(免疫療法あり、50例)とグループB(免疫療法なし、51例)で比較することで行った。
いずれのグループも標準治療として、プラチナ製剤による化学療法は行っている。
免疫療法は自己のがん所属リンパ節から、「AKT-DC」と称した樹状細胞(dendritic cell: DC)と活性化キラーT細胞(activated killer T-cell: AKT)を共に培養したものを利用している。化学療法は4コース行い、免疫療法は10-14コース行った。
図1
図1 は全生存率を示しており、5年生存率ではグループA が81.4%、グループB が48.3% となっている。この両グループ間には有意差が認められ(log-rank testでp=0.0005、Wilcoxon testでp=0.0005)、免疫細胞療法を受けた患者に明らかな有効性が確認できている。またハザード率から、グループAは1/0.229で4.36倍の5年生存率を示している。
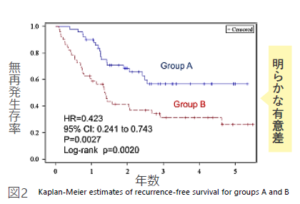
図2
図2 は無再発生存率であり、5年生存率ではグループA が56.8%、グループBが26.2% となっている。この両グループ間には有意差が認められ(log-rank testでp=0.0020、Wilcoxon testでp=0.0027)、免疫細胞療法を受けた患者に明らかな有効性が確認できている。またハザード率から、グループAは1/0.423で2.36倍の5年生存率を示している。
図1,図2に示されたグラフは、肺がんの術後の再発予防に対してAKT-DC療法が高い有効性を示したグラフです。
フェーズⅢの無作為抽出試験の結果をまとめ、論文として出されたもので医学的にエビデンスといわれるレベルのものです。
無再発率と全生存率ともに30%以上の高い有効性を示しています。
また、グラフからわかることは、再発しても再発時期が遅れるなど全体的な寿命が延びる効果が示されています。
私たちは、肺がんに限らない固形がんの手術後の治療に主治医のご協力をいただき、この治療を進めていきたいと考えています。
5年生存率が4倍以上に!!
HR=0.229(HazardRatio)の意味するところ:
治療しない群の生存率を1とすると治療した群の生存率は、1/0.229=4.36倍となります。
たとえば治療しない群の5年生存率が10%とした場合、治療した群の成績は43.6%になる計算です。無再発生存率でも1/0.423=2.36倍になることを意味しています。
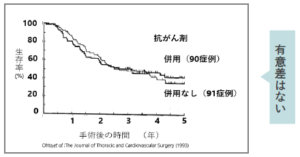
肺がん(Ⅲ期)根治手術後抗がん剤併用による再発防止